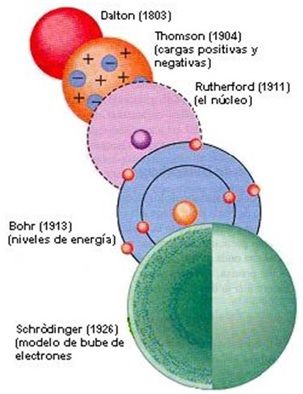
- EL ÁTOMO A TRAVÉS DEL TIEMPO
- Tales de Mileto y Anaxímenes afirmaron que el principio de todas las cosas eran los elementos de agua y aire. Heráclito tomo el elemento primordial como el fuego y Empédocles tomo los 3 anteriores, más el elemento tierra.
- TEORIA DE LOS 4 ELEMENTOS: El agua, el aire el fuego y la tierra se combinaban para formar la materia confiriéndole cualidades fundamentales, presentando forma sólida, líquida y gaseosa y el fuego como agente de cambio.
- ARISTÓTELES Complementa la teoría de los 4 elementos, tomando que todas las experiencias del mundo se deben a 4 cualidades: cálido, frio, seco y húmedo y cuya combinación da como resultado la materia existente.
- LEUCIPO La materia esta constituida por átomos. Fundador de la escuela atomista. DEMÓCRITO Teoría discontinua de la materia: Los átomos son sólidos, indivisibles, indestructibles y eternos, además entre ellos existe espacio vacío. Las diferentes formas de la materia se debe a la reorganización de los átomos.
- LEY DE CONSERVACIÓN DE LA MATERIA “ La materia no se crea, ni se destruye solo se transforma”.
- LEY DE LAS PROPORCIONES CONSTANTES
- Cuando se hacen reaccionar dos elementos químicos para formar un determinado compuesto, dichos elementos siempre reaccionan en la misma proporción.
- LEY DE LAS PROPORCIONES MULTIPLES
- Las cantidades de un mismo elemento, que se combina con una cantidad fija de otro para formar varios elementos, están en una relación de números enteros sencillos
- La materia está constituida por átomos en forma de esfera indivisibles y compactos.-Los átomos que son semejantes entre sí (masa, tamaño, características) y difieren en aquellos que componen otros elementos.-La diversidad de materia se debe a la existencia de átomos diferentes y a sus múltiples combinaciones.- En un cambio químico, los átomos no se crean,Ni se destruyen sino se reordenan.
- ANTECEDENTES DEL MODELO ATÓMICO DE THOMPSON
- TALES DE MILETO ( 600 a.c) comprobó que frotando el ámbar un trozo de ámbar con una piel de animal, adquiría la propiedad de atraer cuerpos ligeros (como trozos de paja y pequeñas semillas). Se creía que la electricidad residía en el objeto frotado. De ahí que el término electricidad provenga del vocablo griego electrón, que significa ámbar.
- AMBAR Es una piedra preciosa hecha de resina vegetal fosilizada, su nombre proviene de una raíz árabe que significa lo que flota en el mar, ya que flota sobre el agua del mar. Es de color marrón claro normalmente.
- ANTECEDENTES MODELO ATÓMICO DE THOMPSON
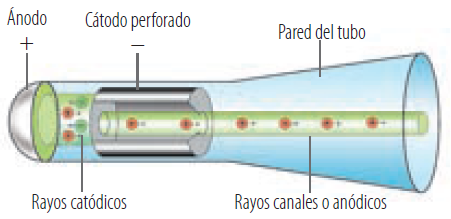
- Crookes crea un tubo de vidrio vacío, por el cual circulan una serie de gases, que al aplicarles electricidad adquieren fluorescencia rayos cargados negativamente o cátodo(electrón), más la parte positiva o ánodo (protón) .El fenómeno de la electricidad permitió hallar la existencia de cargas eléctricas positivas y negativas y su relación con el magnetismo se descubrieron partículas subatómicas(protón, electrón y neutrón).
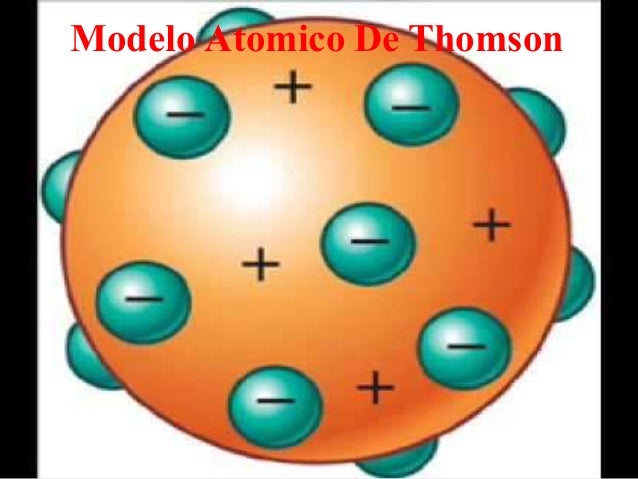
- MODELO ATÓMICO DE THOMSON
- - Los átomos están formados por una masa cargada positivamente, en cuyo interior se encuentran incrustados pequeñas partículas de carga negativa(electrones). -La materia es eléctricamente neutra. -El átomo puede perder(carga positiva) o ganar electrones(carga negativa).
- Goldstien modificó el tubo de rayos catódicos con una perforación y diversidad de gases observando otro tipo de resplandor proveniente del ánodo al que se le llamo protón.
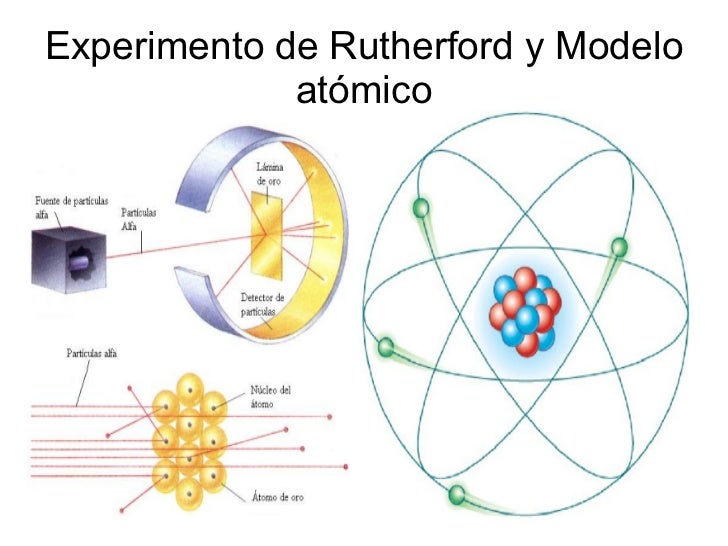
- TEORÍA ATÓMICA DE RUTHERFORD
- -El núcleo del átomo es una región central pequeña cargada positivamente donde se concentra la masa.-Los electrones se mueven alrededor del núcleo(modelo planetario) que contrarrestan la carga positiva del núcleo.
- DESCUBRIMIENTO DEL NEUTRÓN La masa de un átomo es aproximadamente el doble de la masa de los protones y la masa de los electrones es despreciable, deduciendo la existencia de un partícula neutra que posee masa.
- ANTECEDENTES DEL MODELO ATÓMICO DE BOHR
- TEORÍA ELECTROMAGNÉTICA: El electrón debe emitir energía en forma continua hasta caer sobre el núcleo fusionándose con los electrones y en consecuencia, el átomo solo tendría en periodo de vida muy corto.
- ESPECTROS DE RADIACIÓN: Es un conjunto de radiaciones fijas que comprueban que los átomos no despiden energía de forma continua, ya que las radiaciones que lanza tienen solo una energía determinada.
- TEORÍA CUÁNTICA DE LA LUZ: Un cuerpo que se somete a una alta temperatura emite energía discontinua como radiación electromagnética en forma de fotones (luz), donde la intensidad de la radiación depende del número de fotones.
- EFECTO FOTOELÉCTRICO: Cuando se alcanza un valor máximo de radiación necesaria para arrancar un electrón de un metal mediante la producción de luz se produce corriente eléctrica.
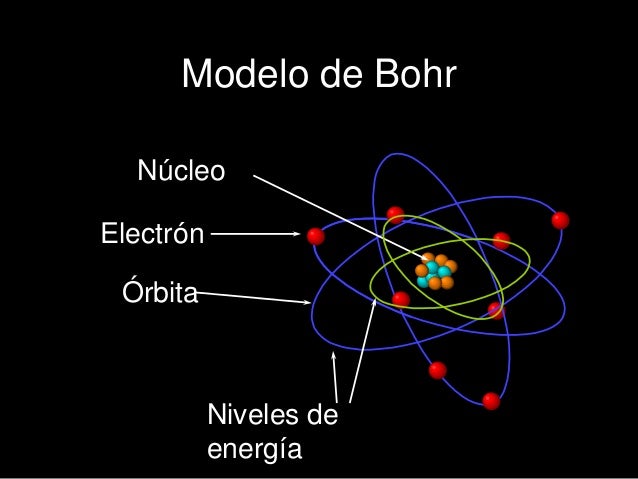
- MODELO ATÓMICO DE BOHR
- Los electrones giran alrededor del núcleo a gran velocidad en un número determinado de orbitales(niveles de energía) definidos.
- -Los electrones puede ganar o perder energía cuando pasa de un orbital a otro.
- -Cada órbita tiene un nivel de energía distinto. A medida que aumenta el nivel también la energía.
- MODELO ATÓMICO ACTUAL
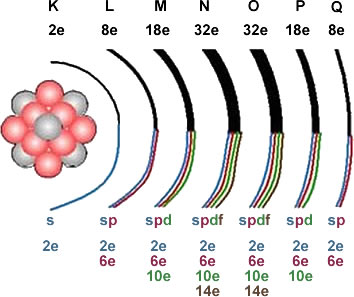
- DISTRIBUCIÓN ELECTRÓNICA Cada orbita posee un determinado nivel de energía (n), cada nivel de energía está representado por una letra mayúscula. NIVEL DE ENERGÍA Indican la distancia existente entre el electrón y el núcleo. A medida que se encuentran más alejados del núcleo los electrones tienen más energía.
- Número de electrones por nivel El número de electrones que pueden entrar en un nivel se calcula mediante la fórmula 2n2 , en donde “n” es el nivel de energía.
- SUBNIVELES Dentro de un nivel de energía hay subdivisiones llamados subniveles, los cuales se simbolizan con las letras minúsculas s,p,d,f.
ACTIVIDAD:
Según los temas vistos en este blog.
1. Escribe el postulado de las siguientes leyes y explica en que consiste, incluye un ejemplo mediante una gráfica.
- Ley de la conservación de la materia
- Ley de las proporciones constantes
- Ley de las proporciones múltiples
2. ¿Cual fue el aporte que Crookes en los modelos atómicos y en que consistió su experimento? incluye una imagen del mismo.