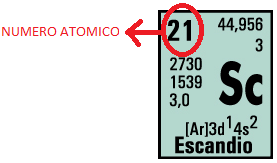
1. NÚMERO ATÓMICO:
Indica
el número de protones presentes en el núcleo; puesto que la carga del átomo es
nulao neutra, también representa la cantidad de electrones presentes en el átomo. Se simboliza con la letra Z
En este caso el escandio por tener número atómico 21, nos da a conocer, que dicho elemento posee 21 protones en su región nuclear y por consiguiente para conservar una carga nula o neutra también posee 21 electrones.
Ahora la pregunta: ¿Cómo calculo los neutrones que tiene un átomo?¿tienen la misma cantidad que los electrones y protones?
Las respuestas son sencillas, eso depende de la peso atómico, del elemento. Sigamos con otro ejemplo, en este caso el elemento plata:
Su peso atómico es 107.86, así que de este número decimal lo convertimos al número entero más próximo, es decir, 108, ésta cifra se convierte en el número másico, que se simboliza con la letra A.
2. NÚMERO MÁSICO: Hace referencia
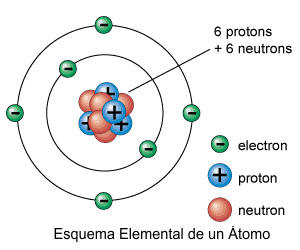
al número de protones y neutrones presentes en el núcleo o también llamado nucleones.
A=
p + n
NÚMERO MÁSICO = PROTONES + NEUTRONES
Entonces deduzcamos:
El número atómico de Ag es 47, por lo tanto posee 47 protones y por consiguiente 47 electrones. Ahora su número másico es 108. es decir que:
108(protones + neutrones) le resto los 47 protones me dará los neutrones que posee el núcleo:
108 - 47 = 61 neutrones
En otras palabras para hallar los neutrones, aplicaré la siguiente fórmula:
A - Z = NEUTRONES
3. ISÓTOPOS
Son
átomos de un mismo elemento cuyo núcleo tiene el mismo número de protones pero
diferente número de neutrones. Los isótopos de un mismo elemento tienen
propiedades químicas similares, la mayoría de los elementos presentan
más de un isótopo natural.
En el caso del carbono presenta 3 isótopos que reciben el nombre de C-12, C-13, C-14, pues su masa atómica varia, Razón por la cual se diferencian por tener diferentes números de neutrones, tal como se demuestra en la gráfica anterior.
4. ISÓBAROS
Son
átomos de elementos diferentes, que presentan igual número másico.
Como vemos en este caso el Calcio y el Argón son dos elementos diferentes, sin embargo si miramos sus masa atómicas al promediarlas, su número másico (A) es igual en ambos casos 40 y por ello se consideran isóbaros.
5. MASA ATÓMICA PROMEDIO
Corresponde
al promedio de los isótopos, teniendo en cuenta su porcentaje de abundancia en
la naturaleza. Ejemplo:
En la
tierra se encuentran 2 isótopos de litio: 6Li (6,01512 uma),
cuyo porcentaje de abundancia en la naturaleza es de 7,42%, Y 7Li (7,01600 uma),
que constituye 92,58% de abundancia. ¿Cuál es la masa promedio?.
¿Que hicimos?, es muy sencillo, multiplicamos el porcentaje de abundancia por la masa atómica en cada isótopo y se divide en 100, para determinar el % promedio.
6. MASA MOLECULAR
Es
la suma de las masa atómicas promedio de los átomos que constituyen una
molécula.
Como vemos en la imagen, el procedimiento en el primer compuesto es:
1° Mirar por cuantos elementos esta formado el compuesto: en este caso posee 2 elementos,
Hidrógeno (H) y Cloro (Cl)
2° Se revisa en la tabla periódica la masa atómica de cada elemento
Hidrógeno= 1.0079 uma
Cloro= 35.4527 uma
3° se suman las masas de todos los elementos en el compuesto.
Dicho resultado es la masa molecular del compuesto, es decir, que la masa del compuesto es 36.4606 uma.
Miremos el segundo ejemplo: El compuesto posee 3 elementos que presentan subíndices, es decir, la cantidad de veces que hay del elemento, en este caso la fórmula posee 6 carbono
12 Hidrógenos y 6 Oxígenos.
La operación se realizará:
Carbono= 12,011 x 6 = 72,06
Hidrógeno= 1,001 x 12 = 12,00
Oxígeno= 15,99 x 6 = 95,94
Masa molecular = 180,00
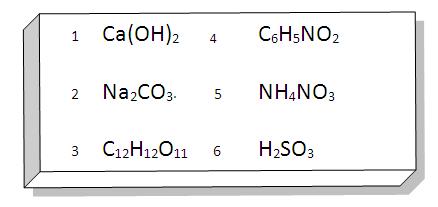
ACTIVIDAD
Repasemos:
Realiza los siguientes ejercicios:
1. Completar la siguiente tabla
1. Completar la siguiente tabla