En ésta clase de nomenclatura se utilizan prefijos que indican el número de átomos presentes en un elemento determinado dentro del compuesto, para ello es necesario memorizarse los prefijos a utilizar:
Para nombrar óxidos, tenemos en cuenta los prefijos según los subíndices que aparecen en la fórmula, teniendo en cuenta que leemos la misma de derecha a izquierda con el siguiente orden:
Prefijo + Óxido + de + prefijo + nombre del elemento
Se debe tener en cuenta en el caso del primer y tercer ejemplo que el prefijo "mono" no se utiliza en el segundo elemento nombrado, ese prefijo es utilizado exclusivamente para el primer elemento; los demás prefijos si se aplican a ambos elementos.
Miremos con detenimiento los dos siguientes ejemplos:
Miremos con detenimiento los dos siguientes ejemplos:
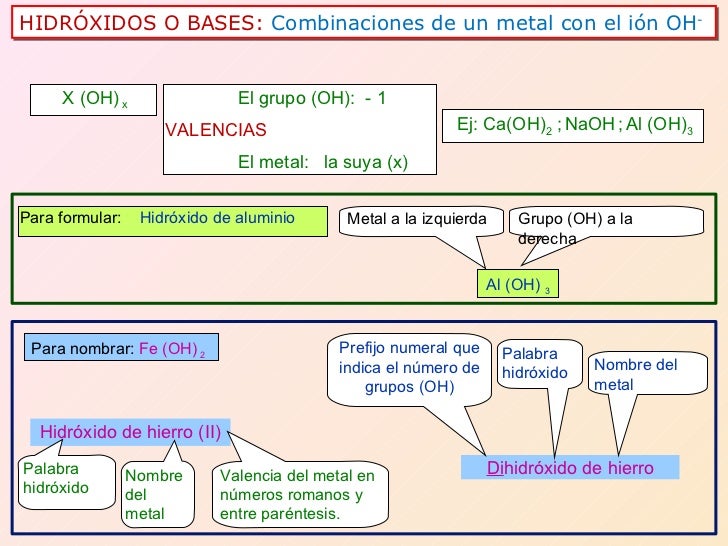
Ahora la misma regla se aplica para nombrar hidróxidos se tiene en cuenta las mismas reglas que en los óxidos, siguiendo el siguiente orden:
Prefijo + hidróxido + de + nombre del metal
Por lo general el prefijo "mono" no se utiliza al nombrar el hidróxido:
Por ejemplo en el compuesto NaOH y CuOH no se utiliza el prefijo "mono" al nombrar los mismos.
ACTIVIDAD:
Dar el nombre a los siguientes óxidos
Br2O3 Cl2O7 CO Cu2O N2O3
P2O5 Cl2O SO3 Al2O3 Fe2O3